就在中國外貿出口企業忙于研究并配合目的國準備各類認證時,來自美國FDA官方的一則聲明,震驚了所有計劃向美國出口防疫物資的外貿物流企業!
市場監督管理總局指南
為做好新冠肺炎疫情防控和經濟社會發展工作,支持企業復工復產,針對企業不熟悉防疫物資出口政策等實際問題,現就口罩等防疫用品出口歐盟及美國的相關準入要求及梳理的國內具有相應資質能力的認證機構名錄提供如下信息指南,供企業參考。 一、歐盟對口罩等防疫用品準入要求
(一)口罩
歐盟根據用途將口罩分為兩類:醫用口罩和個人防護口罩。 1.醫用口罩
醫用口罩需按照歐盟醫療器械指令93/42/EEC(MDD)或歐盟醫療器械條例EU2017/745(MDR)加貼CE標志,對應的標準是EN14683。根據口罩產品無菌或非無菌狀態,采取的合格評定模式也不同。
(1)無菌醫用口罩:必須由授權公告機構進行CE認證。
(2)非無菌醫用口罩:企業只需進行CE自我符合性聲明,不需要通過公告機構認證。在準備好相應文件及測試報告等資料后,即可自行完成符合性聲明。
2.個人防護口罩
個人防護口罩不屬于醫療器械,但需符合歐盟個人防護設備條例EU2016/425(PPE)要求,由授權公告機構進行CE認證并頒發證書,對應的標準是EN149。
(二)防護服
防護服也分為醫用防護服和個人防護服,管理要求與口罩基本類似。醫用防護服按照醫療器械管理,其中無菌醫用防護服需按照歐盟醫療器械指令93/42/EEC(MDD)或歐盟醫療器械條例EU2017/745(MDR)獲得CE認證,非無菌醫用防護服只需進行CE自我聲明。個人防護服需按照歐盟個人防護設備條例EU2016/425(PPE)獲得CE認證。
(三)歐盟公告機構查詢地址
1.歐盟醫療器械指令93/42/EEC(MDD)授權的公告機構查詢地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=13
2.歐盟醫療器械條例EU2017/745(MDR)授權的公告機構查詢地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
3.歐盟個人防護裝備條例EU2016/425(PPE)授權的公告機構查詢地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=155501
二、美國對口罩等防疫用品準入要求
(一)口罩
美國對醫用口罩和防護口罩同樣區分管理,其中醫用口罩由美國食品藥品監督管理局(FDA)管理,而個人防護口罩則由美國國家職業安全衛生研究所(NIOSH)管理。
1.醫用口罩
醫用口罩需通過FDA注冊,企業直接向FDA官網申請并提交相關材料。此外還有兩種可選途徑:
(1)已經獲得NIOSH注冊的N95口罩,在產品生物學測試、阻燃測試和血液穿透測試通過的情況下,可以豁免產品上市登記(510K),直接進行FDA工廠注冊和醫療器械列名。
(2)如果獲得持有510K的制造商的授權,可以作為其代工廠使用其510K批準號進行企業注冊和器械列名。
2.個人防護口罩
防護口罩需通過NIOSH注冊,企業直接在NIOSH官網申請。
(二)防護服
對醫用防護服和個人防護服的管理也類似于口罩的管理方式,其中醫用防護服由美國食品藥品監督管理局(FDA)管理,而個人防護服由美國國家職業安全衛生研究所(NIOSH)管理。企業直接在FDA或NIOSH進行注冊申請。
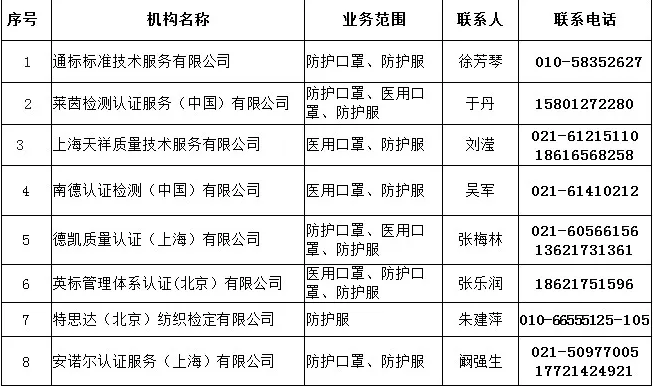
三、中國境內具有口罩等防疫用品CE認證能力的認證機構名錄
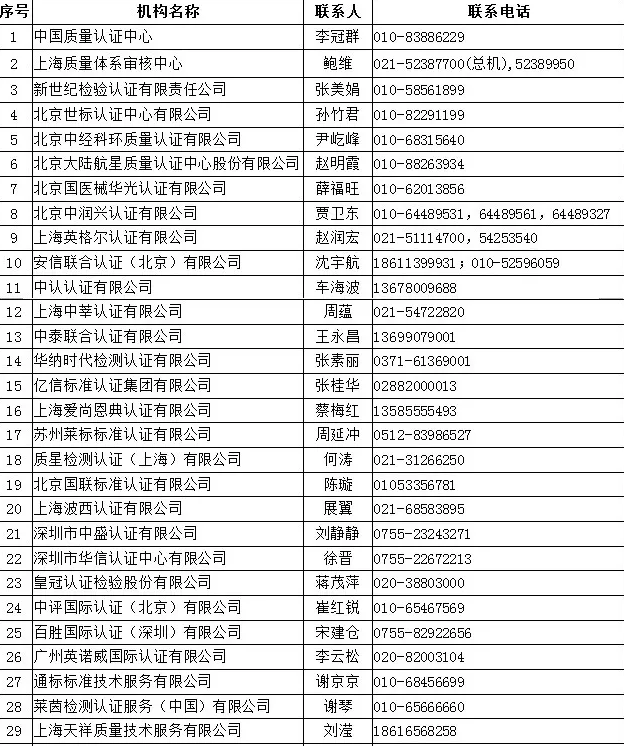
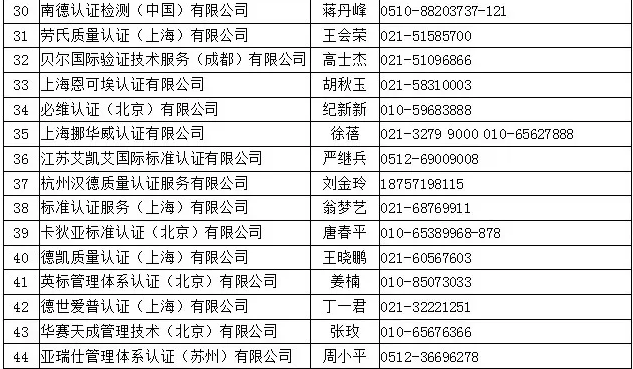
四、中國境內可以開展醫療器械管理體系(ISO13485)認證的機構名錄
市場上所有“FDA注冊證書”都是假的!
據搜航網獲悉:近日,美國食品藥品監督管理局(FDA)通過其官方網站發布聲明,強調FDA從未給任何醫療器械企業和機構簽發過所謂的“RegistrationCertificates”,即市場所謂的“FDA注冊證書”!
以下為FDA官方公告具體內容及鏈接:
公告具體內容:
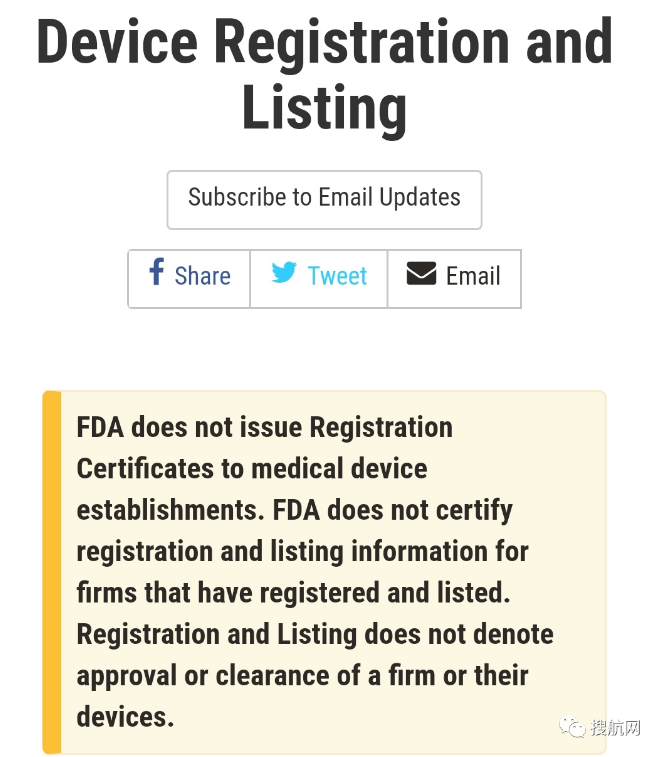
在這份官方公告中,FDA指出:
1.FDA不會向醫療器械企業頒發注冊證書
2.不會對已經注冊或者列名的產品或企業出具確認證書。
3.企業注冊和產品列名信息并不代表FDA批準了該企業和其產品。
這則官方公告,對于被一些認證機構忽悠并熱衷于花錢置辦FDA注冊認證書的外貿出口企業,無疑是一個晴天霹靂。
出口企業注冊關注問題
那么,業界極為關注的FDA注冊是怎么回事呢,外貿出口企業在注冊時一般需要關注哪些問題呢,以下是搜航為大家整理的部分內容供大家參考:
問題一:FDA證書是哪個機構發放的?
答:FDA注冊是沒有證書的,產品通過在FDA進行注冊,將取得注冊號碼,FDA會給申請人一份回函(有FDA行政長官的簽字),但不存在FDA證書一說。
FDA在此時發布這樣一則通告可謂是強提醒!由于近期美國疫情的發展,醫用防疫用品出口美國的需求量大量增加,出口注冊需求也就增多,但是存在一些企業冒充FDA給廠家頒發證書,一些經銷企業在咨詢廠家的時候,拿到的“FDA證書”也可能是假冒的。
問題二:FDA需要指定的認證實驗室檢測嗎?
答:FDA是一個執法機構,而不是服務機構。如果有人說他們是FDA下屬的認證實驗室,那么他至少是在誤導消費者,因為FDA既沒有面向公眾的服務性認證機構與實驗室,也沒有所謂的“指定實驗室”。
FDA作為聯邦執法機構,不可以從事這種既當裁判又當運動員的事。FDA只會對服務性的檢測實驗室的GMP質量進行認可,合格的頒發合格證書,但不會向公眾“指定”,或推薦特定的一家或幾家。
問題三:FDA注冊是否一定需要一位美國代理人?
答:是的,企業在進行FDA注冊時必須指派一名美國公民(公司/社團)作為其代理人,該名代理人負責進行位于美國的過程服務,是聯系FDA與申請人的媒介。
FDA注冊的常見誤區
1、FDA注冊和CE認證不同,他認證的模式不同于CE認證的產品檢測+報告證書模式,FDA注冊實際上采用的是誠信宣告模式,即:你對自己的產品符合相關標準和安全要求負責,并在美國聯邦網站注冊,如果產品出事,那么就要承擔相應的責任。因此FDA注冊對于大部分產品,不存在寄樣品檢測和出證書的說法。
2、FDA注冊有效期問題:FDA注冊有效期為一年,如果超過一年,則需要重新提交注冊,所涉及的年費也需要重新付。
3、FDA注冊是否有證書?
實際上,FDA注冊是沒有證書的,產品通過在FDA進行注冊,將取得注冊號碼,FDA會給申請人一份回函(有FDA行政長官的簽字),但不存在FDA證書一說。我們通常看到的這個證書是中介代理機構(注冊代理)簽發給廠家,以證明其幫助該廠家完成了美國FDA要求的“生產設施注冊和產品類型注冊”,完成的標志是幫助廠家取得了FDA的注冊登記號。

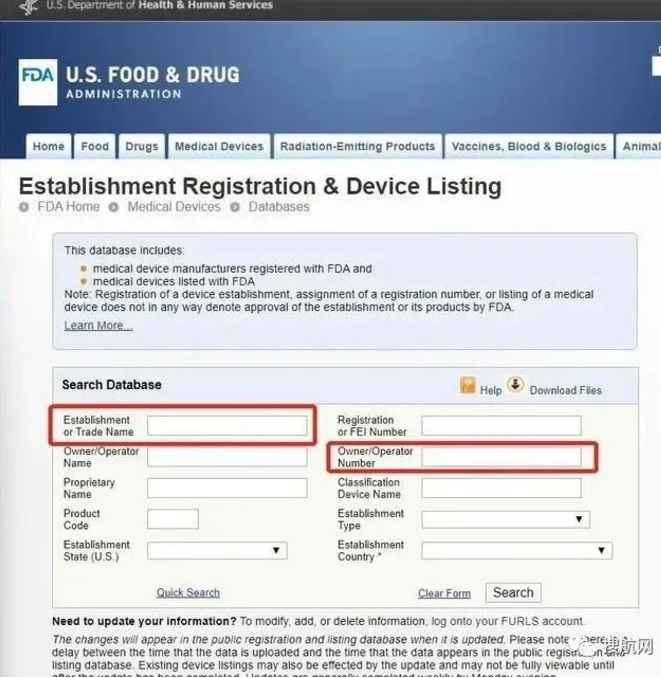
如何查詢產品已經獲得FDA列名或510K注冊?
唯一權威途徑:上FDA官網查詢
FDA列名:

510K注冊:
END






