疫情在全球范圍內的大流行使得口罩等防疫物資成為一季度出口的爆單產品。
韓國、伊朗、土耳其、法國、馬來西亞、泰國、越南、吉爾吉斯斯坦、巴基斯坦、斯里蘭卡、馬爾代夫、巴西、委內瑞拉、津巴布韋、歐亞經濟聯盟等國家或地區均給予相關產品關稅減免或通關便利。
畢竟,當前“一罩難求”的緊急情況下,只有逐漸擺脫疫情、恢復生產的中國有能力滿足如此龐大的醫療物資需求。
但目前口罩等防疫物資出口有了新的變化。

3月17日,美國疾病控制與預防中心(CDC)發布了《優化N95口罩供應策略:危機/替代策略》,指出新冠肺炎疫情期間,當N95口罩供給不足時,按巴西、韓國、日本、澳大利亞、歐盟、墨西哥、中國標準生產的口罩是N95口罩合適的替代品,其中包括采用中國標準GB 2626-2006、GB/T 18664-2002生產的KN100、KP100、KN95、KP95口罩。
但就在美國確診人數瘋狂上漲的情況下,3月28日,美國FDA又發布了一份面向未達NIOSH標準的進口一次性過濾口罩制造商、衛生保健人員、醫院采購部門和分銷商、進口商和商業批發商的“緊急使用管理”信函(Emergency-Use-Administration,簡稱EUA),修改了授權范圍。
根據新的授權范圍,只有澳大利亞、巴西、歐盟、日本、韓國、墨西哥這六個國家和地區滿足要求,中國被剔除在外。
這就意味著,上述六個國家和地區的口罩,如果滿足自己國家或地區的相關標準并取得了相關認證,可以出口美國,但中國標準的KN95等口罩卻不行,必須達到NOISH標準和認證才能在美國醫療機構使用。
美方公告:
www.fda.gov/media/136403/download
截至北京時間4月1日早晨,美國共報告新冠肺炎確診病例186265例,確診數居全球首位。
“當美國各地的醫院拼命尋找N95口罩來保護醫護人員治療新冠肺炎患者時,美國聯邦政府已禁止進口可能是世界上最豐富的替代品。”美版今日頭條BuzzFeed的報道稱,“如果沒有FDA的批準,進口商會猶豫訂購KN95口罩,因為他們擔心會被海關扣押。許多醫院都拒絕接受這些捐贈,即使是免費的,因為他們擔心如果醫護人員在使用未經許可的設備時生病,將會承擔法律責任。”
美國進口商鮑勃·蒂爾頓說,“現在更容易買到KN95口罩,N95很難買到。但我不想為運送口罩而冒險損失50萬或100萬美元。”
而美國總統特朗普則呼吁,美國民眾“可以戴圍巾”來替代口罩。

加拿大政府在接收從中國來的救援設備后,停止把設備分發給各大醫院。加拿大衛生部在致加拿大新聞社的一份聲明中說:“這批貨物的一部分已經交付給相關醫療服務機構。這批貨物的‘口罩部分’則被擱置,沒有進一步分發,接受評估。”
3月29日,加拿大總理賈斯汀·特魯多在新聞發布會上承諾,在確保中國提供的口罩符合質量標準以前,聯邦衛生當局將不再分發救援設備,并不遺余力的調查這批口罩的質量問題。
特魯多說:“我可以向人們保證,加拿大衛生部有很嚴格的程序來評估我們接獲的物資符合必要的標準,并且不會有任何捷徑。”“我們需要確保醫護人員所依賴的用品和設備是安全的,確保他們能夠完成工作的質量,確保他們的安全。”
3月28日荷蘭衛生部發表聲明指,21日收到130萬個標明“KN95”等級的中國制口罩,但當局經兩次測試,發現口罩未能緊貼臉部及過濾病毒功能不合格。而首批60萬只口罩已分發到各地醫院供醫護使用。當局緊急下令全部收回,并將更嚴格地檢測從中國訂購的口罩。
而據西班牙媒體《國家報》、《世界報》等媒體報道,西班牙從中國采購的一批新冠病毒快速檢測試劑盒結果不精確,按要求試劑盒的精確度應超過80%,但這批試劑盒僅為30%。
對此,中國駐西班牙大使館回應稱,試劑盒提供方為深圳一家企業,并不在中國商務部已向西班牙提供的醫療設備銷售企業名單中,且尚未獲得中國國家藥品監督管理局的銷售許可。
西班牙政府則在隨后的一份聲明中表示,這批涉事次品試劑盒并非由西班牙政府直接從中國政府采購,而是通過一家本國供應商從中國生產商處進口。西班牙已立即退回這批試劑盒,并聯系供應商要求用其他試劑盒來替代。
深圳的這家企業則發布申明解釋:經了解,在采樣和樣本提取過程中,可能沒有嚴格按照其操作使用說明來進行鼻咽拭子樣本的采樣、提取和操作,因此導致樣本檢測準確度下降。
目前深圳市市場監督管理局已啟動快速核查,具體情況將持續通報。
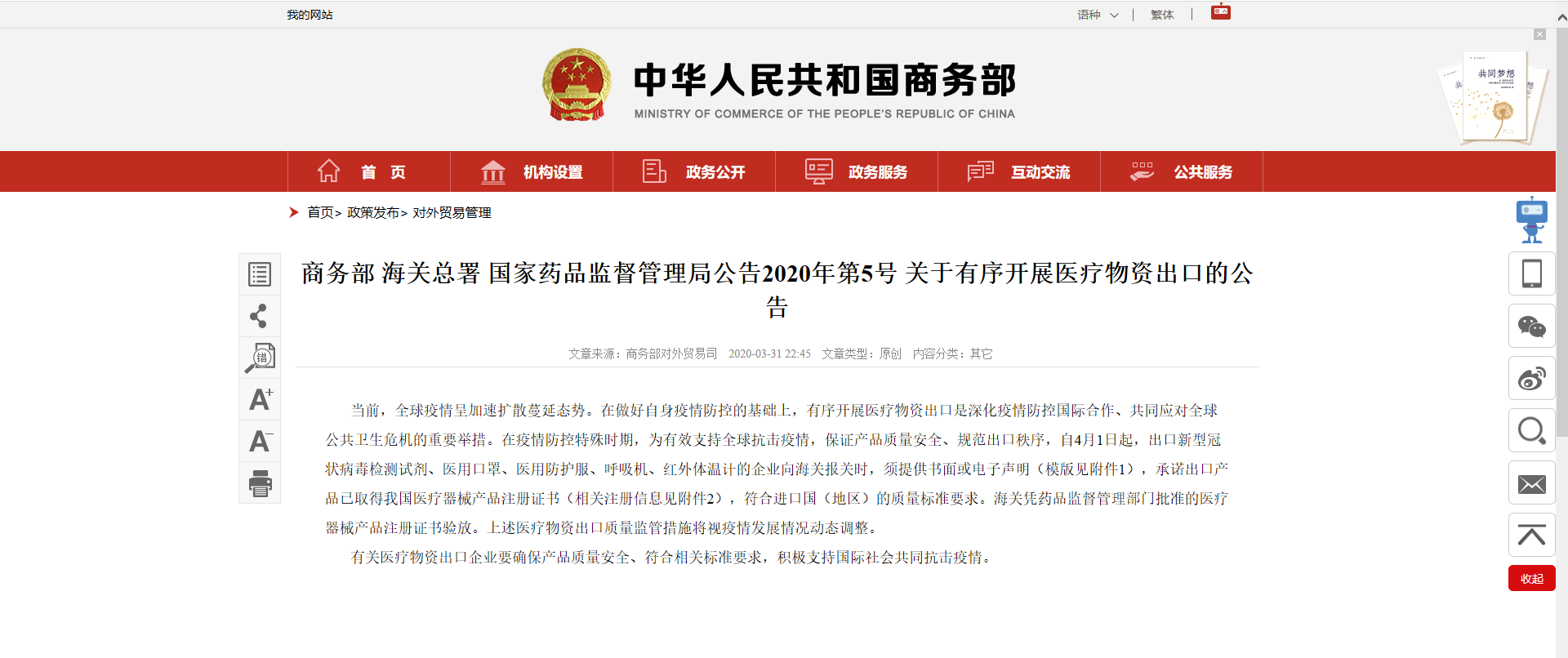
3月31日晚,商務部、海關總署、國家藥品監督管理局緊急發布了一則通知——《關于有序開展醫療物資出口的公告》(2020年第5號)。
公告稱:
“自4月1日起,出口新型冠狀病毒檢測試劑、醫用口罩、醫用防護服、呼吸機、紅外體溫計的企業向海關報關時,須提供書面或電子聲明(模版見附件1),承諾出口產品已取得我國醫療器械產品注冊證書(相關注冊信息見附件2),符合進口國(地區)的質量標準要求。海關憑藥品監督管理部門批準的醫療器械產品注冊證書驗放。上述醫療物資出口質量監管措施將視疫情發展情況動態調整。”
相關新聞:商務部:加強醫療物資出口管理,須提供書面或電子聲明
可在此下載《出口醫療物資聲明模板》和《我國相關醫療器械產品注冊信息(國家藥監局網站www.nmpa.gov.cn動態更新)》。
此外,3月31日下午,國家藥監局藥品監管司召開了2020年藥品上市后監管工作重點任務部署視頻會議。會議內容值得大家引起注意!
會議強調,要妥善做好出口藥品質量監管,嚴格規范藥品出口證明管理,對不符合出證條件和要求、未遵守我國藥品GMP等情形,堅決依法撤銷其藥品出口證明;要繼續加強藥品生產監管,切實保證出口藥品質量符合要求;要加強與市場監管、海關、公安等部門協同,嚴厲打擊違法違規行為。
會議要求,各級藥監部門要加大違法案件查辦力度,按照“四個最嚴”要求,嚴肅查處違法違規行為。要根據實際情況充分運用財產罰、資格罰、自由罰、聲譽罰等手段,切實處罰到企業、處罰到人;還要充分運用告誡、約談、限期整改等措施,對存在質量問題或者其他安全隱患的,依據風險采取暫停生產、銷售、使用、進口等相應控制措施,及時控制風險。各地要強化與市場監管綜合執法機構的協同,加快建立監管與稽查有效銜接機制;深化與公安機關溝通協調,強化行刑銜接,形成案件查辦合力。針對問題風險易發多發的環節或領域,國家藥監局將部署集中開展專項整治,通過整治進一步規范生產經營行為,對發現的違法違規行為嚴肅查處并公開曝光,形成強大震懾效應。

請外貿人務必注意近期醫療器械產品出口的法律風險,供貨緊缺并不等于買家能接受不合格產品,切勿因為市場火爆而盲目入行。
建議出口方:
1.了解各個出口市場的醫療器械產品準入標準,以及認證情況,并對這些信息保持更新。
2.重視認證的真實有效,嚴格審查代理中介的資質,不要選擇那些報價顯著低于正常價格的代理,要知道,無良代理簽發出無效認證,最后倒霉的可是出口商!
3.嚴格按照標準進行生產,保證自身產品合法合規。
4.退潮方知裸泳者,建議謹慎看待這一波“口罩紅利期”。






